Herstellung von Kunststoffen
Polykondensation
Polykondensationen sind Reaktionen, bei denen Polykondensate entstehen. Sie verlaufen in Stufen und unter Abspaltung von Nebenprodukten (normalerweise Wasser, H2O). Schematisch kann man sie sich ungefähr folgendermaßen vorstellen:
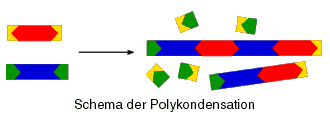
Anhand der schematischen Zeichnung ist sicherlich klargeworden, dass bei der Reaktion der Monomere miteinander ein Nebenprodukt abgespalten wird, doch was bedeutet es, wenn eine Reaktion in Stufen verläuft?
Hierzu muss man den Vergleich sehen zu den Polymerisationsreaktionen, die stufenlos verlaufen: Hier werden bei der Wachstumsreaktion (Propagation) jeweils einzelne Monomere an die immer länger werdende Kette addiert, wenn zwei Ketten miteinander reagieren, bildet sich eine längere Kette, die allerdings nicht weiterreagieren kann (vgl. Kettenabbruch durch Rekombination).
Bei der Polykondensation hingegen gibt es mehr Möglichkeiten für das Kettenwachstum, denn hier können einzelne Monomere an eine bestehende Kette angebaut werden, es können aber auch zwei beliebig lange bzw. kurze Ketten miteinander zu einer längeren reagieren, ohne dass die Wachstumsreaktion dabei beendet wird, denn die funktionellen Gruppen, die zur Reaktion notwendig sind, gibt es schließlich an beiden Enden.
Doch durch welche Reaktionen werden Polykondensate gebildet? Hier gibt es im Wesentlichen die folgenden beiden Reaktionsmöglichkeiten:
- Esterbildung (Veresterung): Hierbei entstehen Polyester und Polycarbonate
- Carbonsäureamidbildung: Hierbei entstehen Polyamide
Veresterung - Polyesterbildung
Ein Ester bildet sich, wenn ein Alkohol und eine Carbonsäure unter Abspaltung von Wasser miteinander reagieren, wobei die Reaktion nur säurekatalysiert ablaufen kann, d.h. es müssen Protonen (H+) vorhanden sein. Die Reaktion ist eine Gleichgewichtsreaktion, der Ablauf ist folgender:
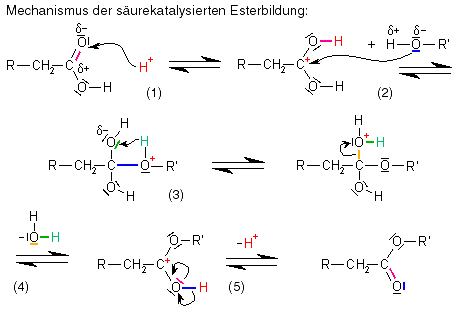
Hier die genauere Erläuterung der einzelnen Teilschritte:
- Ein Proton (H+) lagert sich an das negativ polarisierte
 Carbonyl-Sauerstoffatom der Carbonsäure an, die positive Ladung wird auf das Carbonyl-Kohlenstoffatom verschoben, es bildet sich ein Carbokation, das leicht von
Carbonyl-Sauerstoffatom der Carbonsäure an, die positive Ladung wird auf das Carbonyl-Kohlenstoffatom verschoben, es bildet sich ein Carbokation, das leicht von  Nucleophilen angegriffen werden kann.
Nucleophilen angegriffen werden kann. - Ein Alkohol lagert sich an die Carbonsäure an, dabei wird eine kovalente Bindung zwischen dem negativ polarisierten, nucleophilen Sauerstoffatom der
 Hydroxylgruppe des Alkohols und dem positiv geladenen,
Hydroxylgruppe des Alkohols und dem positiv geladenen,  elektrophilen Kohlenstoffatom der Carbonsäure gebildet, und die positive Ladung verschiebt sich auf das Sauerstoffatom des Alkohols (was dem stark elektronegativen, elektronenziehendem Sauerstoff nicht gefällt und das Molekül sehr instabil macht).
elektrophilen Kohlenstoffatom der Carbonsäure gebildet, und die positive Ladung verschiebt sich auf das Sauerstoffatom des Alkohols (was dem stark elektronegativen, elektronenziehendem Sauerstoff nicht gefällt und das Molekül sehr instabil macht). - Das positiv geladene Sauerstoffatom will die positive Ladung loswerden und gibt daher ein Proton (H+) ab, dieses lagert sich an das nächstliegende Sauerstoffatom an, woraufhin dieses die positive Ladung bekommt (was natürlich auch nicht ideal ist).
- An das nun positiv geladene Sauerstoffatom sind bereits zwei Wasserstoffatome gebunden, für den Sauerstoff ist es also kein Problem, sich das Elektronenpaar zu schnappen, mit dem er an das Kohlenstoffatom gebunden ist und sich so als (ungeladenes) Wassermolekül (H2O) vom Rest des Moleküls abzuspalten. Die positive Ladung ist nun wieder am Kohlenstoffatom, wo sie zu Beginn schon einmal war.
- Das Molekül ist auch mit der positiven Ladung am Kohlenstoff nicht wirklich stabil, daher wird ein Proton (H+) von der noch vorhandenen Hydroxylgruppe abgespalten (die Umkehrreaktion von Schritt 1): Wir haben einen Ester erhalten!
Polyester sind Stoffe, bei denen viele Monomere durch Esterbindungen miteinander verknüpft sind, sodass Polymere entstanden sind. Hierfür reicht es natürlich nicht aus, Monomere mit jeweils nur einer funktionellen Gruppe zu haben, denn diese könnten ja nur eine Esterbindung ausbilden und keine weitere. Um einen Polyester zu erhalten, benötigt man also Monomere mit (mindestens) zwei funktionellen Gruppen pro Monomer, und hier gibt es zwei verschiedene Möglichkeiten, nach denen zwei Typen von Polyestern unterschieden werden: Die Monomere von Polyester-Typ I sind Hydroxycarbonsäuren, Polyester des Typ II werden aus Dicarbonsäuren und Dialkoholen hergestellt.
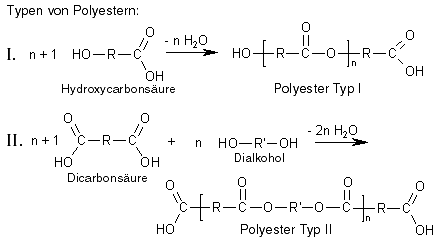
Haben wir nun Monomere wie die oben gezeigten, also Monomere mit zwei (gleichen oder unterschiedlichen) funktionellen Gruppen, so gibt es nach jeder Veresterung immer noch "unverbrauchte" funktionelle Gruppen, die weitere Esterbindungen ausbilden können, sodass schließlich Polyester entstehen.
Polyamidbildung
Die Polyamidbildung hat, was den Reaktionsmechanismus angeht, große Ähnlichkeit mit der Polyesterbildung: Bei beiden Reaktionen wird ein ![]() Nucleophil an das
Nucleophil an das ![]() Carbonyl-Kohlenstoffatom einer Carbonsäure addiert, der erste Reaktionsschritt (Addition eines Protons an den Carbonyl-Sauerstoff und Bildung eines Carbokations) ist sogar derselbe. Der Unterschied ist, dass das Carbokation nicht mit einem Alkohol reagiert wie bei der Esterbildung, sondern mit einem Amin, und dass dementsprechend ein Carbonsäureamid entsteht und kein Ester.
Carbonyl-Kohlenstoffatom einer Carbonsäure addiert, der erste Reaktionsschritt (Addition eines Protons an den Carbonyl-Sauerstoff und Bildung eines Carbokations) ist sogar derselbe. Der Unterschied ist, dass das Carbokation nicht mit einem Alkohol reagiert wie bei der Esterbildung, sondern mit einem Amin, und dass dementsprechend ein Carbonsäureamid entsteht und kein Ester.
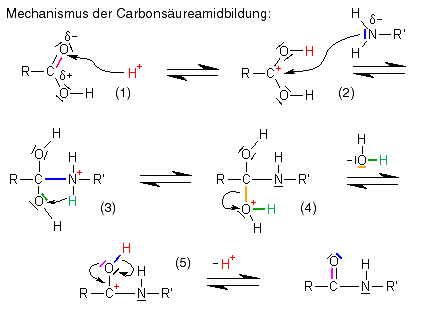
- Bildung eines Carbokations, indem sich ein Proton (H+) an das negativ polarisierte Carbonyl-Sauerstoffatom anlagert.
- An das Carbokation lagert sich ein Amin an, indem es mit seinem freien Elektronenpaar eine kovalente Bindung zum positiv polarisierten Kohlenstoffatom bildet, die positive Ladung verschiebt sich auf das Stickstoffatom.
- Das jetzt positiv geladene Stickstoffatom gibt ein Proton (H+) und damit die positive Ladung ab, das Proton lagert sich an das nächstliegende Sauerstoffatom an, woraufhin dieses die positive Ladung bekommt (was dem stark elektronegativen Sauerstoff nicht gefällt).
- An das nun positiv geladene Sauerstoffatom sind jetzt zwei Wasserstoffatome kovalent gebunden, er kann also leicht mitsamt beiden Wasserstoffatomen und dem Elektronenpaar, mit dem er an den Rest des Moleküls gebunden ist, als (ungeladenes) Wassermolekül (H2O) vom Rest des Moleküls abgespalten werden. Die positive Ladung ist nun wieder am Kohlenstoffatom, wo sie zu Beginn schon einmal war.
- Das Molekül ist auch mit der positiven Ladung am Kohlenstoff nicht wirklich stabil, daher wird ein Proton (H+) von der noch vorhandenen Hydroxylgruppe abgespalten: Es ist ein Carbonsäureamid entstanden!
Für die Polyamidbildung gilt ebenfalls das, was oben zur Polyesterbildung gesagt wurde: Als Monomere müssen Moleküle verwendet werden, die mindestens zwei funktionelle Gruppen besitzen, damit die Reaktion an beiden Enden der Monomere stattfinden und sich eine Polymerkette bilden kann. Entsprechend den beiden Polyestertypen gibt es hier also auch zwei Typen von Polyamiden: Zum einen gibt es den AS-Typ, bei dem die Monomere Aminosäuren (abgekürzt AS) sind, also Stoffe, die als funktionelle Gruppen sowohl eine Amino- als auch eine Carboxylgruppe besitzen, zum anderen gibt es den AA-SS-Typ, der aus zwei unterschiedlichen Monomeren gebildet wird, nämlich aus einem Diamin (AA) und einer Dicarbonsäure (SS).
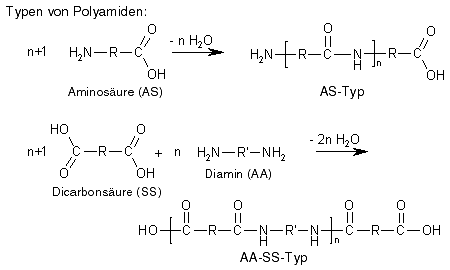
Ansonsten verläuft die Wachstumsreaktion, d.h. die Kettenverlängerung, wie oben beschrieben in Stufen: Mit beiden Enden einer bestehenden Kette können einzelne Monomere reagieren und so die Kette verlängern, es können aber auch zwei beliebig lange (oder kurze) Ketten miteinander reagieren und eine längere Kette bilden, ohne dass die Wachstumsreaktion dadurch beendet wird.
Copyright © mk 2000