Sonstiges
Glossar
- Brönstedt-Säuren
- Carbonylgruppe
- elektrophil
- Hydroxylgruppe
- Kovalente Bindung
- Lewis-Säuren und -Basen
- nucleophil
- Polykondensation
- Polymerisation
- ungesättigt
- Van-der-Waals-Kräfte
- Ziegler-Natta-Katalysatoren
Brönstedt-Säuren
Nach der Definition von Johannes Nicolaus Brønstedt sind Säuren Stoffe, die Protonen (H+) abgeben, Basen dementsprechend Stoffe, die Protonen aufnehmen können.
Die Beziehung zwischen Säure und Base ist folgende:
Säure ![]() Base + Proton
Base + Proton
oft auch dargestellt als: HA ![]() A- + H+
A- + H+
Stoffe wie Wasser (H2O), die sowohl sauer als auch basisch reagieren können, werden als "Ampholyte" bezeichnet.
HOH + HOH ![]() H3O+ + OH-
H3O+ + OH-
Carbonylgruppe
Die Carbonylgruppe besteht aus einem Kohlenstoffatom (Carbonyl-Kohlenstoffatom), an das durch eine Doppelbindung ein Sauerstoffatom gebunden ist:
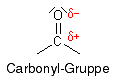
Aufgrund der größeren Elektronegativität des Sauerstoffs ist dieser negativ polarisiert und damit nucleophil, das Kohlenstoffatom hingegen ist positiv polarisiert und daher elektrophil: Nukleophile können also mit dem Kohlenstoffatom reagieren, Elektrophile mit dem Sauerstoffatom.
Die Carbonylgruppe kommt in Aldehyden und Ketonen, in Carbonsäuren (als "Carboxylgruppe" zusammen mit einer Hydroxylgruppe), Estern, Amiden und etlichen anderen organischen Verbindungen vor.
elektrophil
Als elektrophil werden Teilchen bzw. Atome bezeichnet, die von negativen Ladungen angezogen werden (griech. philos = "Freund", Elektron dürfte klar sein). Sie selbst sind positiv geladen oder positiv polarisiert und können mit Nucleophilen reagieren.
Typische Nucleophile sind Carbokationen und H+, generell alle Lewis-Säuren.
Hydroxylgruppe
Die Hydroxylgruppe ist die funktionelle Gruppe der Alkohole und Phenole, sie kommt zusammen mit der Carbonylgruppe als "Carboxylgruppe" in den Carbonsäuren vor.
Kovalente Bindung
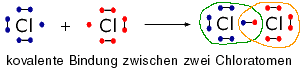
Die kovalente Bindung wird auch Atombindung oder Elektronenpaarbindung genannt, sie verbindet zwei Atome miteinander, die sich hierbei Elektronen teilen, um Edelgaskonfiguration (8 Elektronen in der äußersten Schale) zu erhalten. Beispiel: Chlor hat 7 Valenzelektronen und bildet daher eine kovalente Bindung zu einem anderen Chloratom aus, und durch die gemeinsame Nutzung eines Elektronenpaares ist jedes Chloratom von 8 Elektronen umgeben:
Lewis-Säuren und -Basen
Die Säure-Base-Definition von Lewis ist allgemeiner als die von Brønstedt. Laut Lewis sind Säuren Elektronenpaarakzeptoren, d.h. sie können ein Elektronenpaar von einem anderen Stoff aufnehmen. Basen sind Elektronenpaardonatoren, d.h. die Stoffe, die mindestens ein freies Elektronenpaar haben, das sie den Lewis-Säuren zur Verfügung stellen können. Diese Definition beinhaltet auch Metallkationen und Elektronenmangelverbindungen (Verbindungen, deren äußere Schale nicht komplett gefüllt ist) wie z.B. AlCl3.
nucleophil
Als nucleophil werden Teilchen bzw. Atome bezeichnet, die von positiven Ladungen angezogen werden (griech. philos = "Freund", nukleos = "Kern", und der Atomkern besteht ja bekanntlich aus positiv geladenen Protonen). Sie selbst sind negativ geladen oder negativ polarisiert und besitzen mindestens ein freies Elektronenpaar, mit dessen Hilfe sie mit positiv geladenen oder polarisierten Teilchen (Elektrophilen) reagieren können.
Typische Nucleophile sind Lewis-Basen wie z.B. Anionen, Carbonylverbindungen (Aldehyde, Ketone, Carbonsäuren), Alkohole, Amine, Ammoniak.
Polykondensation
Bei der Polykondensation reagieren Monomere, die über zwei oder mehr funktionelle Gruppen verfügen, miteinander zu Polymeren, genauer gesagt zu Polykondensaten.
Die Polykondensation verläuft in Stufen, und bei der Reaktion der Monomere werden Nebenprodukte (meist Wasser) abgespalten.
Die zwei wichtigsten Reaktionsmechanismen für Polykondensationen sind die Veresterung, die zur Bildung von Polyestern führt, und die Carbonsäureamidbildung, durch die Polyamide entstehen (näheres s. auf der Seite zur Polykondensation).
Polymerisation
Polymerisationen sind Polyreaktionen, d.h. Reaktionen, bei denen aus Monomeren Polymere entstehen, sie sind industriell sehr bedeutend, weil ein Großteil der Kunststoffe durch Polymerisationen hergestellt wird.
Die Wachstumsreaktion bei Polymerisationen verläuft ohne erkennbare Stufen und ohne Abspaltung von Nebenprodukten, die Monomere enthalten mindestens eine Doppelbindung anhand derer sie sich an die wachsende Polymerkette addieren.
Für nähere Informationen siehe die Seite zu Polymerisationen.
ungesättigt
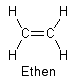
Als ungesättigt bezeichnet man in der organischen Chemie alle Verbindungen, die Doppel- oder Dreifachbindungen zwischen zwei Kohlenstoffatomen enthalten. Die einfachste ungesättigte Verbindung ist Ethen:
Van-der-Waals-Kräfte
Van-der-Waals-Kräfte gehören zu den zwischenmolekularen Kräften, wobei sie die schwächsten sind und nur eine geringe Reichweite haben. Sie kommt dadurch zustande, dass die Elektronen, die den Atomkern bzw. ein Molekül umgeben, nicht immer gleichmäßig um den Kern bzw. den Mittelpunkt des Moleküls verteilt sind, sondern sich zufällig auch in einer Hälfte des Atoms/Moleküls sammeln können. Dadurch entstehen "momentane Dipole", d.h. die Hälfte mit der höheren Elektronendichte ist negativ polarisiert und die andere, der die Elektronen "fehlen", positiv polarisiert. Eine negative und eine positive Hälfte ziehen sich wie kleine Magneten an.
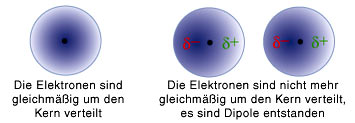
Die Polarisierung der Atome bzw. Moleküle ist von sehr kurzer Dauer, da die Elektronen ständig in Bewegung sind, allerdings entstehen dadurch immer neue Dipole, sodass immer eine geringe Anziehung zwischen den einzelnen Teilchen besteht.
Die Van-der-Waals-Kräfte sind umso stärker, je größer Atome und Moleküle sind: Einerseits gibt es bei größeren Teilchen insgesamt mehr Elektronen, andererseits sind die viele Elektronen weiter vom positiven Elektronkern entfernt, sie können also deutlich leichter verschoben werden und "Elektronenhaufen" bilden.
Ziegler-Natta-Katalysatoren
Katalysatorsysteme, bestehend aus einem Katalysator, normalerweise eine Übergangsmetallverbindung wie z.B. TiCl4, TiCl3 oder VCl4 und einem Co-Katalysator, üblicherweise eine aluminiumorganische Verbindung, z.B. Al(C2H5)3 oder Al(C2H5)2Cl:
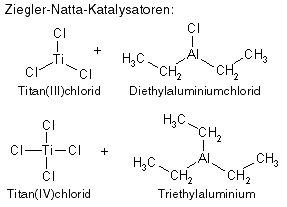
Ziegler-Natta-Katalysatoren werden verwendet zur Herstellung von Kunststoffen bestimmter Taktizität (s. Ziegler-Natta-Polymerisation) oder zur Herstellung von alternierenden Copolymeren.
Copyright © mk 2000