Herstellung von Kunststoffen
Polyaddition
Die Polyaddition verläuft wie die Polykondensation in Stufen, d.h. die Monomere können an beiden Enden reagieren, und so entstehen zunächst kurze Molekülketten aus wenigen Monomeren (Oligomere), die miteinander oder auch mit längeren Ketten reagieren können. Der wesentliche Unterschied zur Polykondensation ist, dass hierbei keine Nebenprodukte abgespalten werden, sondern dass die Monomere miteinander reagieren, indem sich Atome und Elektronenpaare verschieben. Schematisch kann man sich das ungefähr so vorstellen:

Die wichtigsten Polyadditionen ist die Herstellung von Polyurethanen, von Polyharnstoffen und von Epoxidharzen.
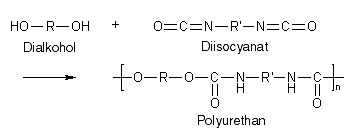
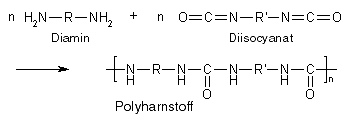
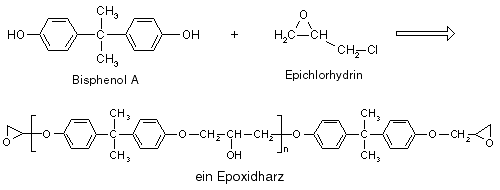
Im Folgenden soll stellvertretend für alle Polyadditionen die wichtigste Polyaddition, nämlich die Herstellung von Polyurethanen, ausführlich beschrieben werden.
Herstellung von Polyurethanen
Polyurethane werden aus Dialkoholen und Diisocyanaten synthetisiert (s.o.), und damit die Reaktion in Gang kommt, benötigt man Katalysatoren, z.B. Diazobicyclo[2.2.2]octan (abgekürzt DABCO):
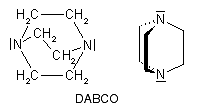
Initiation
DABCO besitzt zwei freie Elektronenpaare und ist ein ![]() Nucleophil, d.h. es wird von positiv polarisierten oder geladenen Atomen angezogen. Ein solches positiv polarisiertes Atom ist das Wasserstoffatom, das zur
Nucleophil, d.h. es wird von positiv polarisierten oder geladenen Atomen angezogen. Ein solches positiv polarisiertes Atom ist das Wasserstoffatom, das zur ![]() Hydroxylgruppe des Dialkohols gehört. DABCO bildet eine Wasserstoffbrückenbindung zu dem Wasserstoffatom der Hydroxylgruppe aus, die positive Polarisierung verschiebt sich auf das Stickstoffatom, die Polarisierung des Komplexes wird größer, weil der Abstand der polarisierten Atome größer geworden ist.
Hydroxylgruppe des Dialkohols gehört. DABCO bildet eine Wasserstoffbrückenbindung zu dem Wasserstoffatom der Hydroxylgruppe aus, die positive Polarisierung verschiebt sich auf das Stickstoffatom, die Polarisierung des Komplexes wird größer, weil der Abstand der polarisierten Atome größer geworden ist.
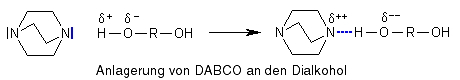
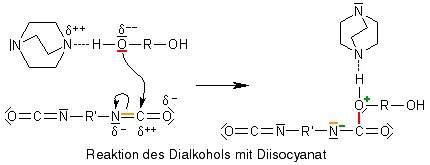
Aufgrund der stärkeren Polarisierung ist das Sauerstoffatom reaktiver als vorhin, es sucht sich daher einen Reaktionspartner, mit dem es seinen Elektronenüberschuss teilen kann, also ein elektronenarmes, ![]() elektrophiles Atom. Ein solches ist das Kohlenstoffatom in der Isocyanatgruppe des Diisocyanats: Es ist umgeben von zwei elektronegativeren Atomen, einem Sauerstoffatom und einem Stickstoffatom und daher stark positiv polarisiert und gut von unserem negativ polarisierten Sauerstoffatom angreifbar.
elektrophiles Atom. Ein solches ist das Kohlenstoffatom in der Isocyanatgruppe des Diisocyanats: Es ist umgeben von zwei elektronegativeren Atomen, einem Sauerstoffatom und einem Stickstoffatom und daher stark positiv polarisiert und gut von unserem negativ polarisierten Sauerstoffatom angreifbar.
Das Sauerstoffatom bildet mit einer seiner freien Elektronenpaare eine Bindung zum elektrophilen Kohlenstoffatom aus, wobei sich eines seiner Bindungselektronenpaare zum Stickstoffatom verschiebt: Schließlich besitzt das Sauerstoffatom eine negative und das Stickstoffatom eine positive Teilladung.
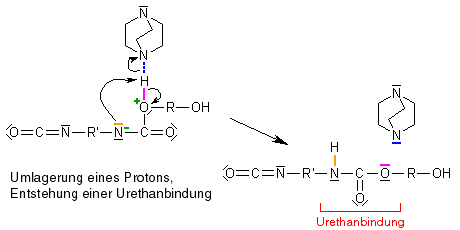
Das Stickstoffatom ist mit seiner negativen Teilladung nicht glücklich und will sie gerne loswerden, und das Sauerstoffatom fühlt sich mit seiner positiven Teilladung auch nicht wohl. Wie lässt sich das ändern?
Die Lösung ist einfach: Das Stickstoff bindet mit einer seiner freien Elektronenpaare das Wasserstoffatom, das am positiv geladenen Sauerstoff hängt, und das Elektronenpaar, das Wasserstoff und Sauerstoff verbindet, bleibt beim Sauerstoff, d.h. das Wasserstoff geht als Proton (H+) an das Stickstoffatom, nimmt also die positive Ladung mit. Die entstehende Gruppierung, die die beiden Monomere verbindet, heißt "Urethanbindung". Unser Katalysator DABCO löst dabei die Wasserstoff-Brückenbindung und ist frei, um eine Wasserstoff-Brückenbindung mit der nächsten Hydroxylgruppe auszubilden.
Wachstumsreaktion
Die Wachstumsreaktion verläuft wie bei der Polykondensation in Stufen. Betrachtet man das im ersten Reaktionsschritt entstandene Produkt, so sieht man, dass aus den beiden Monomeren ein bifunktionelles Molekül entstanden ist: An einem Ende befindet sich eine Isocyanatgruppe, am anderen Ende eine Hydroxylgruppe, und erstere kann mit einem weiteren Dialkohol reagieren, letztere mit einem weiteren Diisocyanat, sodass die Molekülkette länger wird. Allerdings gibt es auch weitere Reaktionsmöglichkeiten: Da jedes Produkt, egal aus wie vielen Monomeren es besteht, an jedem Ende je eine funktionelle Gruppe hat, können auch Kettenstücke verschiedener Länge miteinander reagieren und so längere Molekülketten bilden, solange bis schließlich Polyurethane entstehen.
Copyright © mk 2000