Herstellung von Kunststoffen
Radikalische Polymerisation
Bei der radikalischen Polymerisation reagieren, wie der Name schon sagt, Radikale, das sind Teilchen, die ungepaarte Elektronen besitzen und daher in der Regel sehr reaktiv sind.
Und nochmal zur Erinnerung: Eine Polymerisationsreaktion lässt sich in folgende vier Schritte einteilen:
- Initiation (auch als Kettenstart oder Primärreaktion bezeichnet)
- Wachstumsreaktion (auch Aufbau- oder Fortpflanzungsreaktion oder Propagation genannt)
- Kettenübertragung
- Kettenabbruch (Termination)
Initiation
Zur Initiation der Reaktion dient ein sogenannter "Starter", der Radikale liefert, häufig verwendete Starter sind Benzoylperoxid oder 2,2'-Azo-bis-isobutyronitril (AIBN): Diese Moleküle zerfallen leicht und bilden dabei Radikale (die gebogenen Pfeile zeigen die Wanderung einzelner Elektronen):
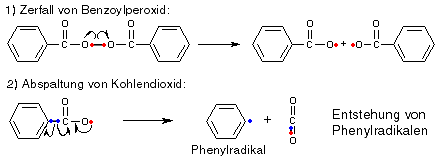
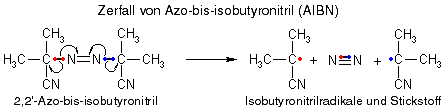
Die entstandenen Radikale mit ihren ungepaarten Elektronen versuchen jetzt, Elektronen zu finden, die sie mit ihrem einzelnen Elektron paaren können, um wieder "komplett" zu sein. Gute Elektronenlieferanten sind C=C-Doppelbindungen, wie sie z.B. in Ethen vorkommen, denn diese sind leicht von Radikalen angreifbar. Kommt unser Starterradikal also in die Nähe eines Ethenmoleküls, schnappt es sich ein Elektron der Doppelbindung und geht damit eine Bindung zum Ethen ein. Wer die Elektronen nachzählt, stellt fest, dass aber auch jetzt ein ungepaartes Elektron übrigbleibt, wir haben also immer noch ein Radikal (wenn auch ein größeres), das mit einem weiteren Ethenmolekül reagieren kann, d.h. die Kettenreaktion hat begonnen.
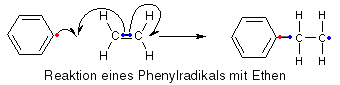
Wachstumsreaktion
Damit sind wir auch schon bei der Wachstumsreaktion (wissenschaftlich "Propagation") angelangt. Hier geschieht, wie der Name sagt, das Wachstum der Moleküle, d.h. im Falle der radikalischen Polymerisation, dass das Radikal immer wieder mit Ethenmolekülen reagiert und die Molekülkette somit immer länger wird.
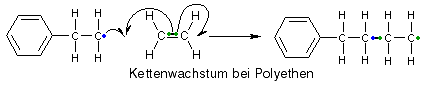
Eine Reaktion wie diese, die von sich aus immer weitergeht, solange noch reaktionsfähige Teilchen vorhanden sind, wird "Kettenreaktion" genannt. Theoretisch könnte sie immer weitergehen, aber neben der Wachstumsreaktion gibt es auch andere Reaktionen, die ein weiteres Wachstum der Kette verhindern, indem sie Radikale "vernichten" und so zum Kettenabbruch führen.
Kettenabbruch
Der Abbruch einer radikalischen Kettenreaktion geschieht am häufigsten durch Rekombination oder durch Disproportionierung, man kann aber auch "Radikalfänger" zum Reaktionsgemisch hinzugeben, die - wie ihr Name sagt - die Radikale wegfangen, sodass sie nicht weiterreagieren können.
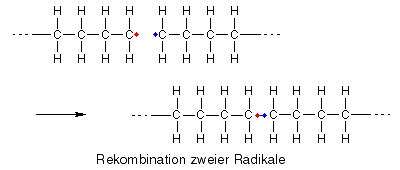
Kettenabbruch durch Rekombination
Bei der Rekombination bilden zwei Radikale aus ihren beiden ungepaarten Elektronen ein bindendes Elektronenpaar, aus zwei Teilchen entsteht also eines, das kein Radikal und somit nicht mehr reaktiv ist.
Kettenabbruch durch Disproportionierung
Diese Art des Kettenabbruchs ist etwas komplexer als die Rekombination, sie beruht darauf, dass ein Radikal sich statt dem ungepaarten Elektron eines anderen Radikals auch ein Elektron mitsamt Wasserstoffatom aus einer C-H-Bindung eines anderen Radikals schnappen kann, mit seinem ungepaarten Elektron und dem Wasserstoffatom nun selbst eine C-H-Bindung ausbilden kann und somit kein Radikal mehr ist. Genauer gesagt, nimmt es einem anderen Radikal dasjenige Wasserstoffatom mitsamt Elektron weg, das dem Kohlenstoffatom mit dem ungepaarten Elektron benachbart ist. Das andere Radikal besitzt nun zwei ungepaarte Elektronen, die sich allerdings an benachbarten C-Atomen befinden, sodass sie sich leicht zu einem bindenden Elektronenpaar zusammentun können, wodurch eine Doppelbindung entsteht.
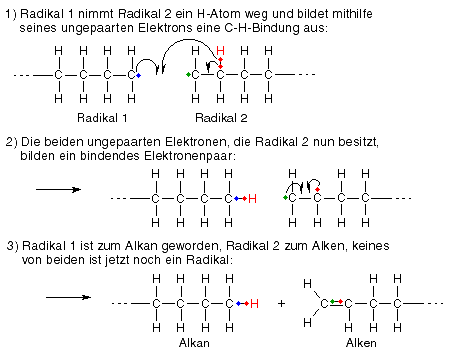
Fazit: Es entstehen ein Alkan und ein Alken, keines von beiden besitzt noch ungepaarte Elektronen, die radikalische Kettenreaktion ist hier zuende.
Kettenübertragung
Diejenigen, die mitgedacht haben, haben sich sicher schon gefragt, wieso ich die Kettenübertragung zunächst ausgelassen habe, obwohl sie oben vor dem Kettenabbruch genannt war. Dies hängt schlicht und einfach damit zusammen, dass Kettenübertragung und Kettenabbruch durch Disproportion nach demselben Prinzip funktionieren, der Unterschied ist nur, dass sich das erste Radikal nicht dasjenige Wasserstoffatom mitsamt Elektron nimmt, das dem Kohlenstoffatom mit dem ungepaarten Elektron benachbart ist, sondern irgendein Wasserstoffatom mitten aus der Kette. Dadurch bleibt mitten in der Kette ein Kohlenstoffatom mit einem ungepaarten Elektron übrig.
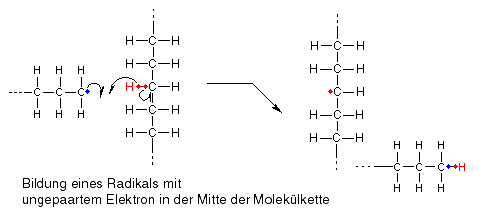
Da aber nicht wie oben am Nachbaratom ebenfalls ein ungpaartes Elektron vorhanden ist, kann keine Elektronenpaarbindung ausgebildet werden, das Molekül hat nun eine neue Möglichkeit, mit Ethenmolekülen zu reagieren. Indem es das tut, beginnt eine neue Kette irgendwo in der Mitte der ursprünglichen Kette zu wachsen, die Molekülkette verzweigt sich.
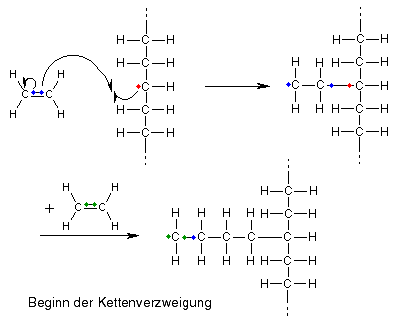
Doch wieso heißt das Ganze Kettenübertragung?
Gute Frage, denn schließlich wird nicht ein Stück Kette von einem Molekül übertragen, wie der Name vielleicht zunächst nahelegt. Tatsächlich übertragen wird genau betrachtet "nur" ein einziges Wasserstoffatom, aber dadurch befindet sich das ungepaarte Elektron und damit die Möglichkeit, mit weiteren Monomeren zu reagieren, nicht mehr an der ursprünglichen Kette, sondern an der anderen, die das Wasserstoffatom verloren hat, sodass die Wachstumsreaktion hier weitergehen kann, indirekt also letztendlich doch eine Kette bzw. die Voraussetzung für die Ausbildung einer Kette von einer Kette auf die andere übergeht.
Copyright © mk 2000