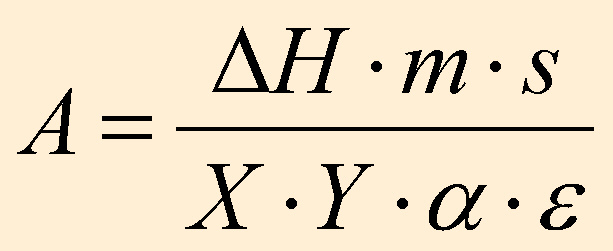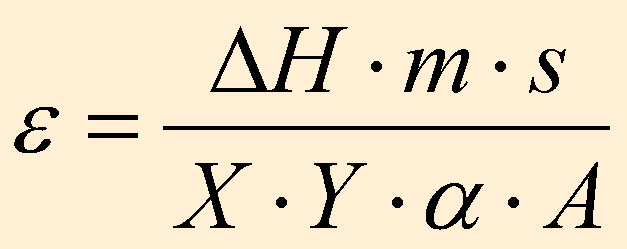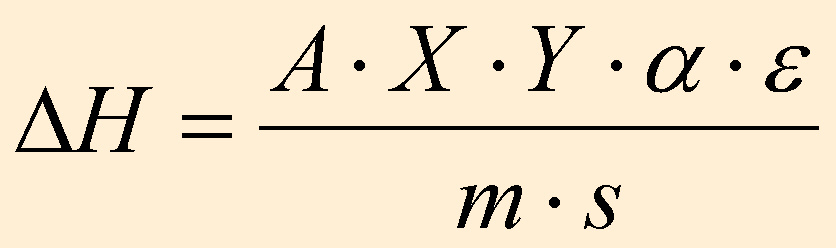Material und Methoden II
Durchgeführte Versuche
Inhalt:
Unsere Aufgabe bestand darin, für die jeweiligen Durchläufe (Kationen-, bzw. Anionenmessung)
die entsprechenden Puffer und Standards herzustellen. Die Standards enthalten die messbaren
Kationen bzw. Anionen in definierten Konzentrationen. Von diesen wird eine Verdünnungsreihe
hergestellt, die immer vor den eigentlichen Proben zur Ermittlung der Regressionsgeraden
gemessen wird.
Kationen-Puffer:
2,5 ml OFM Anion Bt (Waters)
5 ml Chromatkonzentrat
pH mit 10 mM H2SO4 auf 7,7 einstellen
mit Aqua bidest ad 100 ml auffüllen
Lösung vakuumfiltrieren und entgasen
Kationen-Standard: (Verdünnungen: 1:1(unverdünnt) 1:2,5 1:5 1:10 1:20)
Ammonium 0,25 mmol/l
Kalium 0,25 mmol/l
Calcium 0,25 mmol/l
Natrium 1 mmol/l
Magnesium 0,25 mmol/l
Anionen-Puffer:
0,0677 g a Hydroxyisobutyric Acid; Watres, Part No. 54775
0,0528 g18-Crown-6 Ether (99,5 %; 1 g; Aldrich: 27,498-4)
64 µl CIA-PAK UV CAT I Reagenz (4 ml; Waters: WAT054780)
mit Aqua bidest ad 100 ml auffüllen
Lösung vakuumfiltrieren und entgasen
Anionen-Standard: (Verdünnungen von beiden
Standards: 1:1(unverdünnt) 1:2,5 1:5 1:10)
1.
Chlorid 2 mmol/l
Sulfat 0,25 mmol/l
Nitrat 0,25 mmol/l
Succinat 0,25 mmol/l
Acetat 0,25 mmol/l
Lactat 0,25 mmol/l
2.
Chlorid 1 mmol/l
Hydrogencarbonat 0,25 mmol/l
Unsere Gruppe führte im ersten Teil die Anionenmessung durch. Wir ermittelten die
Regressionsgerade für jedes Anion, mit der aus der Fläche unter den Peaks die Konzentrationen der
in der Probe enthaltenen Ionen errechnet werden können, und die relativen Laufzeiten der Ionen in
Bezug auf den Chloridpeak. Außerdem analysierten wir Leitungswasser aus zwei verschiedenen
Berliner Haushalten (LW 1: Tempelhof; LW 2: Prenzlauer Berg) auf ihre Ionenzusammensetzung und
die Konzentrationder enthaltenen Ionen. Um die relativen
Laufzeiten bestimmen zu können, gaben wir Chlorid zu den Proben mit einer Konzentration von
1 mmol/l hinzu.
Die andere Gruppe führte die Kationenmessungen außer an den Standards auch an vier verschiedenen
Mineralwassern (Fürst Bismarck, Vittel, Apolinaris und Christinen Brunnen) durch. In unserer
Auswertung betrachteten wir von diesen Ergebnissen nur die gemessenen Calciumkonzentrationen.
Für die Messungen setzten wir zuerst einen Standard an, in
den zu der Cäsiumchlorid/Lanthanchlorid-Pufferlösung Aqua bidest und
verschiedene Konzentrationen von Ca / ml Ca Cl2 gegeben wurden. Die
erhaltenen Lösungen hatten folgende Konzentrationen in µCa / ml: 0 (Blindwert) ;
0,5 ; 1 ; 2 ; 4 ; 8.
Um den Einfluß von HCl auf die Messergebnisse zu ermitteln, gaben wir zu einem Standard
mit mittlerer Ca-Konzentration unterschiedliche HCl-Konzentrationen.
Den gleichen Versuch wiederholten wir mit NaCl.
Pipettierschema:
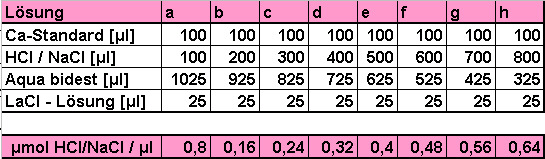
Weiterhin wollten wir die Nachweisgrenze der Messungen
bestimmen. Dazu setzten wir eine Lösung A an, die eine Ca-Konzentration nahe
der Nachweisgrenze besaß (0,5 µCa / ml), und eine Lösung B mit der doppelten
Konzentration.
Dann führten wir 20 mal folgende vier Messungen
hintereinander durch:
Blindwert – Lösung A – Blindwert – Lösung B.
Zur Berechnung der Nachweisgrenze wurden die beiden
Blindwerte, die vor und nach der Messung der Lösung A bzw. B gemacht wurden, gemittelt
und vom Messwert der Lösung abgezogen.
Dann wurden die Mittelwerte und Standardabweichungen für die
beiden Lösungen gebildet und mit folgender Formel die Nachweisgrenze berechnet.
Nachweisgrenze = (c[Bezugslösung]*2*SD) / (berechneter Mittelwert)
Abschließend bestimmten wir noch die Ca-Konzentration in
verschiedenen Mineralwassern (Vittel,
Christinenbrunnen, Fürst Bismarck, Apolinaris). Dazu verdünnten wir sie einmal 1:10 und
einmal 1:100 und bildeten den Mittelwert aus den beiden Messungen.
Diese Ergebnisse sollen mit denen aus der CE gewonnenen Werten und den tatsächlich in
den Wassern enthaltenen Konzentrationen (Angaben auf den Flaschen) verglichen werden.
Die Aufgabe bestand hierbei darin, die Kalibrierungsfaktoren und den Punkt X
mit Hilfe von Benzoesäure für die einzelnen Bomben zu bestimmen.
Dann sollte der Energiegehalt folgender Proben ermittelt werden, um sie zu vergleichen:
- Schokolade
- Diabetikerschokolade
- Butter
- Margarine
Da diese Proben wegen ihrer Konsistenz nur in einer Gelatinekapsel auf den
Probenteller aufgebracht werden konnten, mußte zusätzlich der Energiegehalt
der Gelatinekapseln bestimmt werden.
Wir kalibrierten zuerst das System mit Hilfe von Indium,
indem wir das Aufheizen von 130 auf 190°C in unterschiedlichen
Geschwindigkeiten durchführten. Die Heizraten waren 5, 10, 15 und 20°C/min. Uns
interessierte, inwieweit die Peak-Onset-Temperatur und die Fläche unter
den Peaks abhängig sind von der Heizrate.
Die Fläche A unter den Peaks der Thermogramme hängt vom Faktor e
und folgenden Größen ab:
m = Masse des Stoffes [g]
s =
Aufheizungsgeschwindigkeit [°C/s]
DH
= Energiegehalt des Stoffes [J/g]
und den Einstellungen am Gerät:
X = [mV/cm]
Y = [mV/cm]
a = [°C/mV]
= [°C/mV]
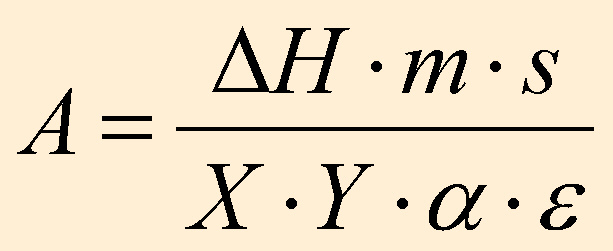
Mit Hilfe von Indium, dessen Energiegehalt bekannt ist, wird e
folgendermaßen berechnet:
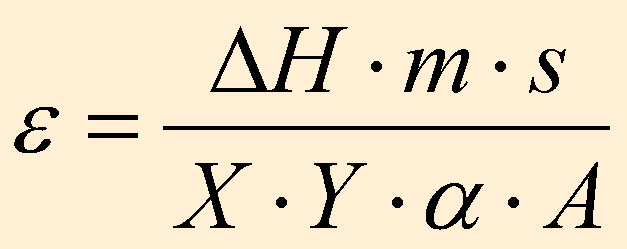
Mit e ist es dann möglich,
den Energiegehalt er anderen eingewogenen Proben zu bestimmen:
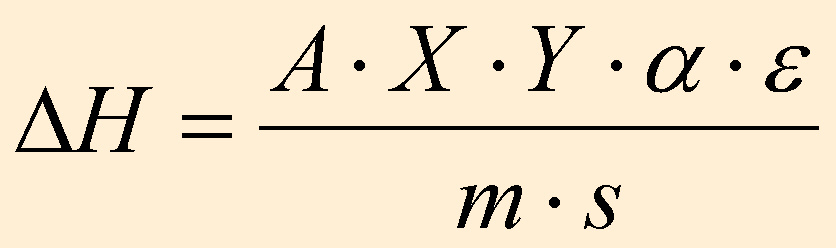
Die zu bestimmenden Proben sind:
Benzoesäure
Ammoniumnitrat
Cholesteryloleat
Glycerinpalmitat
Cholesterylchlorid
Cholesterylpalmitat
Außerdem sollten wir die Zusammensetzung einer unbekannten
Probe durch Vergleich der Energiegehalte und Peakonset-Temperatur mit denen der
bereits gemessenen Stoffen bestimmen.
In der zweiten Woche beschäftigten wir uns mit der Schlammschnecke Lymnaea stagnalis.
Versuchstier:Lymnaea stagnalis
GASTROPODA
Unterklasse: PULMONATA (Lungenschnecke)
Ordnung : BASOMMATOPHORA (Wasserlungenschnecke)
Familie. LYMNAEIDAE

Lymnaea stagnalis
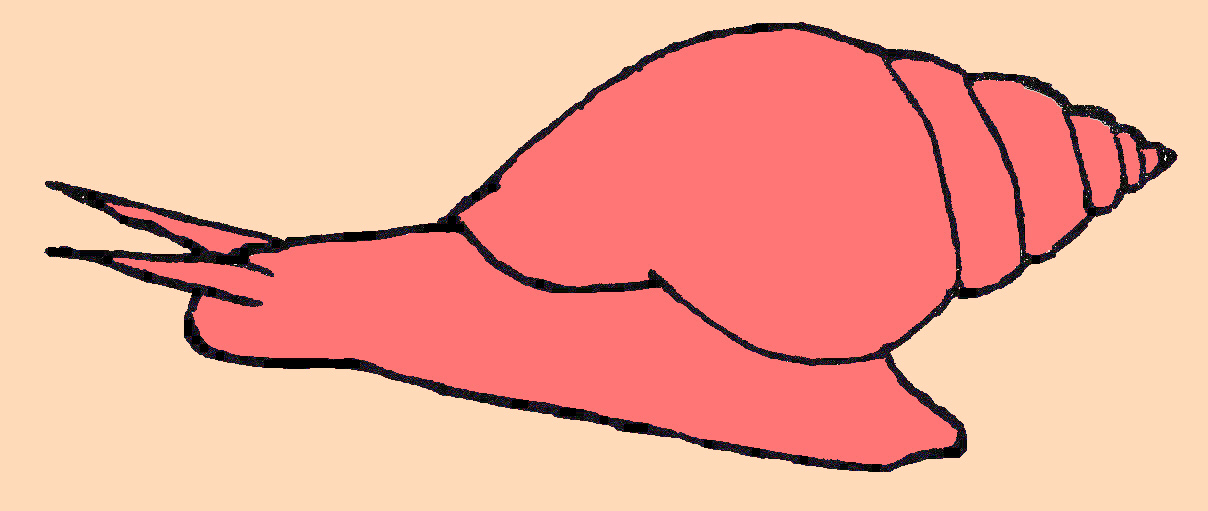
Als Versuchstier diente uns die große Spitzschlammschnecke Lymnaea stagnalis, auch bekannt unter dem Namen
"Große Schlammschnecke". Die Form ihres Gehäuses entspricht
einem Oval mit einem schlanken spitzendendendem Gewinde. Das hornfarbene
Gehäuse ist sehr transparent, dünnwandig und porös. Das
Gehäuse mißt zwischen 50 und 60 mm in der Höhe und 20 bis
30 cm in der Breite. Die ohrförmige Mündung kann bis zu 35 mm
erreichen.
Als Biotop bevorzugt diese Wasserlungenschnecke, wie ihr Name
schon verrät, tiefe Schichten träger, fließender oder
gar stehender Gewässer. Lymnaea stagnalis ist sowohl in Europa weit
verbreitet als auch in Nordasien und Nordamerika.
Die Familie der
Lymnaeidae besitzt eine besonders starke Bedeutung bei parasitologischen
Untersuchungen, da es sich um häufige Zwischenwirte für
unterschiedliche Leberegelarten handelt: Bis zu 30 unterschiedliche
Zerkarienarten wurden bei der Spitzschlammschnecke festgestellt.
Ziel unserer Versuch war es, den Einfluß von unterschiedlich langen Hungerzeiten auf diverse
physiologische Parameter zu untersuchen. Hierfür wurden Gruppen von min. 6 Tieren benutzt und die
Fütterung folgenderweise eingestellt:
Gruppe:
1d : 6 Individuen mit einer Hungerperiode von einem Tag
3d : 6 Individuen mit einer Hungerperiode von 3 Tagen
6d : 6 Individuen mit einer Hungerperiode von 6 Tagen
Kontrolle 1 : 6 Individuen als Kontrollgruppe für 1d mit normaler Fütterung
Kontrolle 3,6 : 6 Individuen als Kontrollgruppe für die Gruppen 3d und 6d
In der Woche vor dem eigentlichen Versuch erhielten alle Tiere Salat als Futter.
Untersuchte Parameter und Verfahren
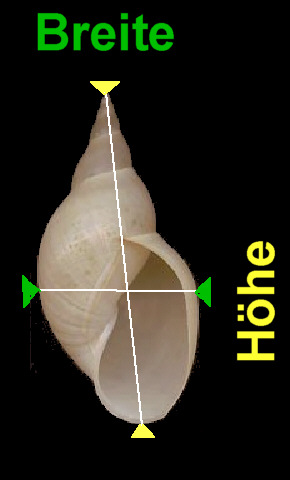
a) Messung der Höhe und Breite der Schale:
Diese Parameter wurden mittels einer Schiebelehre gemessen. Zur Definition der Höhe und Breite: siehe Skizze.
b) Gesamtmasse der Tiere:
Die Gewichtsermittlung erfolgte anhand der laboreigenen Präzisionswaagen (Sartorius L610D Laboratory; Sartorius 2006MP)
c) Ionenkonzentration der Hämolymphe
Mittels eines Schleifbohrers wurde ein kleines rundes Fenster in die Schale der Schnecken zwischen der 2. und 3. Naht abgeschliffen. Schleift man die Öffnung zu nah an der Mündung, kann die Hämolymphabnahme durch den starken Rückzug des Fußes misslingen. Die gröberen Schalenpartikel an der Oberfläche des Loches wurden sorgfältig entfernt, da sie sich störend auf das Pipetieren der Hämolymphe und die späteren Ionenmessungen auswirken. Zum Pipetieren benutzten wir Nadelpipetten deren eines Ende durch erhitzen spitzgezogen wurde. Am anderen Ende befestigten wir einen dünnen langen Plastikschlauch. Die Spitze der Pipette wird leicht unter die Hautoberfläche eingeführt. Durch den hohen Druck der Hämolymphe und der Feinheit der Kapillare erfolgt meistens automatisch ein starker Sog der Hämolymphe in die Kapillare. Andern falls wurde der Schlauch mit dem freien Ende in den Mund geführt und die Flüssigkeit leicht angesaugt. Trotz der Länge der Schläuche sollte man unbedingt vorsichtig saugen, um die Kontamination mit möglichen
Zerkarien der Hämolymphe zu vermeiden.
Die abgenommene Flüssigkeit wurde gefiltert durch Auftragen auf einen Amicon-Filter, welcher sich in kleinen Eppendorfgefäßen befindet. Durch 5-minütiges zentrifugieren bei 14.000 g (Biofuge von Heraeus) wird dann die Flüssigkeit durch den Filter gedrückt. Diese Spezialfilter sind mit Synthese-Rückständen benetzt und müssen vorab 2 mal gewaschen werden: hierfür werden sie in mit destilliertem Wasser benetzt und ebenfalls 5 Minuten zentrifugiert. Die Bestimmung der Ionenkonzentrationen erfolgte durch Analyse von 100 µL 1:100 verdünnter Hämolymphproben an der Kapillarelektrophorese. (CE System Waters Quanta 4000)
d) Tierfrischgewicht evtl. Schalengewicht
Nach der Hämolymphabnahme wurden die Tiere zur Tötung schnellstens in ein Dewangefäß mit flüssigem Stickstoff bei -70°C getaucht. Nach max. 1 Minute wurden die Tiere entnommen und zum auftauen aufbewahrt. Anschließend wurde das gesamte Gewebe aus der Schale entfernt und in ein größeres vorgewogenes Eppendorf-Gefäß überführt und das Tierfrischgewicht gewogen.
Im Verlauf der Versuche beobachteten wir, dass viel von der Körperflüssigkeit durch die vorangegangene Hämolymphabnahme, das Gefrieren und Wiederauftauen und der Überführung in die Einwiegegefäße verloren geht. Deshalb ermittelten wir in einigen Fällen ein "echtes Frischgewicht", welches jedoch lediglich zur Fehlerbetrachtung herangezogen wurde:
Echtes Frischgewicht = Tiermasse mit Schale - Gewicht der Schale
e) Tiertrockengewicht
Die Eppendorfgefäße mit dem Schneckengewebe wurden über Nacht in einem Trockenschrank (Marke Heraeus) bei ca. 60°C getrocknet und abermals gewogen. Die Differenz zwischen dem Frischgewicht und dem Trockengewicht ergibt den Wassergehalt für jedes Tier (in % vom Frischgewicht).
f) Energiegehalt des Gewebes
Das getrocknete Gewebe jedes Tieres wurde vorsichtig und möglichst vollständig aus dem Eppendorfgefäß entfernt. Das getrocknete Gewebe wurde anschließend im Mörser zerrieben. Das erhaltene Pulver wurde dann in eine vorgewogene Gelatinekapsel überführt. Durch die oben geschilderte Methode der Bombenkalorimetrie konnte dann der Energiegehalt des Pulvers ermittelt werden, welcher sich aus der gesamten ermittelten Energie abzüglich des Energiegehaltes der Kapsel ergibt.
Als zusätzlicher Test wurde der Energiegehalt von einer bestimmten Menge gemörserter Schale bestimmt.
Für statistische Auswertungen wurde One-way ANOVA verwendet. Das Signifikanzniveau ist 0,05.





![]() = [°C/mV]
= [°C/mV]