Ergebnisse der 1. Woche:
Ergebnisse der CE:
Durch Ermittlung einer Eichgeraden aus verschiedenen Konzentrationen und zugehörigen Flächen unter den Peaks für alle Ionen konnten für jedes Ion eine spezifische Zusammenhangsgleichung ermittelt werden zur Bestimmung unbekannter Konzentrationen aus bekannter Fläche unter den Peaks. Durch Ermittlung der durchschnittlichen relativen Laufzeiten (bei Anionen in Bezug zu Chlorid; bei Kationen in Bezug zu Natrium) wurden zunächst die verschiedenen Ionen in den Proben identifiziert und dann über die ionenspezifische Gleichung quantifiziert.
|
|
|
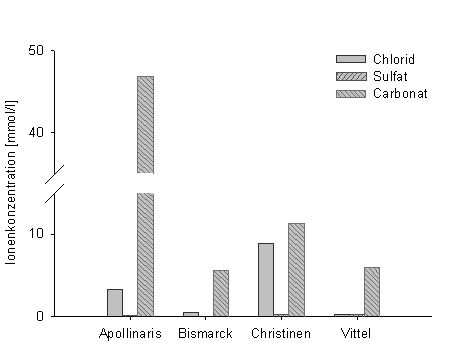
Abb. 2: Konzentrationen verschiedener Anionen in Mineralwassern (Datentabelle 2) |
|
|
|
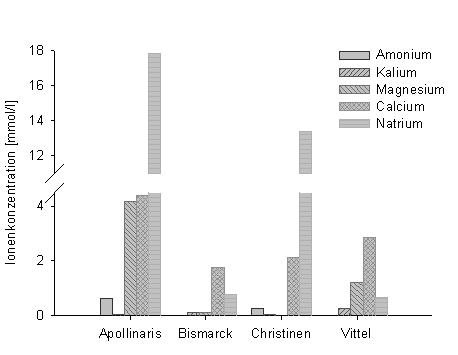
Abb. 3: Konzentrationen verschiedener Kationen in Mineralwassern (Datentabelle 2) |
Allgemein lässt sich zunächst sagen, dass das Mineralwasser Bismarck von nahezu allen Ionen die geringste Konzentration enthält. Apollinaris und Christinen enthalten mit die höchsten Konzentrationen an Natriumchlorid. Weiterhin enthält Apollinaris im Vergleich die höchste Konzentration an Calciumcarbonat. Apollinaris hat eine mehr als 4 mal höhere Konzentrationen an Magnesium wie die anderen Mineralwasser. Die Sulfatkonzentration ist bei allen Mineralwassern außer Bismarck ungefähr gleich. Apollinaris enthält im ganzen von allen Ionen fast immer die höchste Konzentration. Ammonium und Magnesium sind in einigen Mineralwassern entweder gar nicht enthalten oder in so geringen Konzentrationen, dass sie unter die Nachweisgrenze fallen.
Ergebnisse der DSC
Die Kalibrierung der DSC mit Indium und die verwendeten Formeln sind im Folgenden dargestellt:
|
Scanning rate [°C/min] |
5 |
10 |
15 |
20 |
|
Scanning rate [°C/s] |
0,0833 |
0,1666 |
0,2500 |
0,3333 |
|
Fläche 1 [cm²] |
2,14 |
4,25 |
6,08 |
8,24 |
|
Fläche 2 [cm²] |
2,06 |
4,26 |
6,24 |
8,00 |
|
Fläche 3 [cm²] |
2,10 |
4,16 |
6,06 |
8,00 |
|
Durchschnittsfläche [cm²] |
2,10 |
4,22 |
6,13 |
8,08 |
|
Länge Kurve [cm] |
24,5 |
23,8 |
24,1 |
23,6 |
|
Länge Kurve [mV] |
2,45 |
2,38 |
2,41 |
2,36 |
|
a [°C/mV] |
24,49 |
25,21 |
24,90 |
25,42 |
|
E [mW/mV] |
0,57500 |
0,555926 |
0,581532 |
0,575988 |
Die spezifische Empfindlichkeit E des Kalorimeters lässt sich nun mit
![]()
oder nach E umgeformt mit
![]()
berechnen. Aus den Messungen ergibt sich für das Kalorimeter eine spezifische Empfindlichkeit von E = 0,57211 mW/mV.
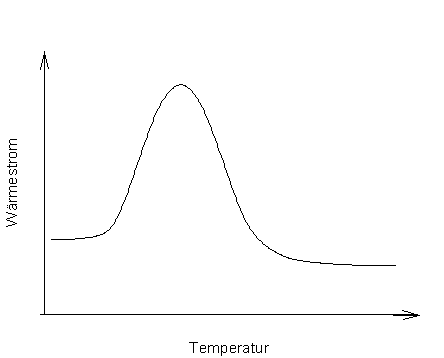
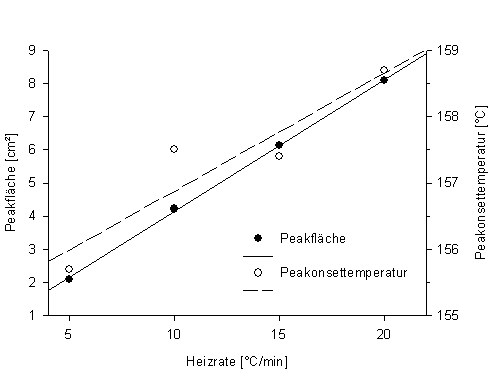
Die Aufheizgeschwindigkeit wirkt sich in sofern auf die Form des Thermogramms aus, als das die Kurve in die Breite gezogen wird. Bei einer höheren Aufheizrate verschieben sich die Maxima nach oben. Wenn man zwei benachbarte Peaks noch trennen will sollte man eine geringe Heizrate wählen, da diese dann durch die Stauchung der Kurve in Längsrichtung seitlich auseinander geschoben werden.
|
|
|
Abb. 4: Thermogramm einer Substanz bei reversiblem Aufheizen und Abkühlen (Schema) |
|
|
|
Abb. 5: Peakfläche und Peakonsettemperatur in Abhängigkeit von der Heizrate bei DSC von Indium (Datentabelle 3) |
Ergebnisse der Messungen verschiedener Substanzen:
Aus den gemachten Messungen ist für das unbekannte Gemisch keine eindeutige Zuordnung der Substanzen möglich. Aus den freigewordenen Mengen an Energie könnte man schließen, dass es sich um Cholesterylchlorid und evtl. Ammoniumnitrat handelt. Aus den Peakonsettemperaturen, an denen diese Energie frei wurde könnte man auch auf zum einen Ammoniumnitrat und zum zweiten evtl. auf Cholesterylpalmitat schließen. Da sich dies nicht einwandfrei klären lässt, kann man auch keine Zuordnung treffen, in welchen Mengenverhältnissen sich die Substanzen im Gemisch befanden.
Ergebnisse der Verbrennungskalorimetrie
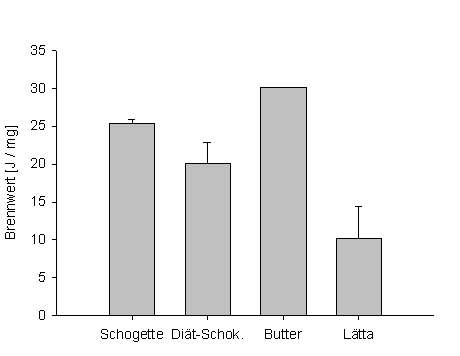
Die Messung der Energiegehalte zeigt deutlich, dass die Diätprodukte tatsächlich weniger Hauptenergiespeichersubstanzen (Fette, Kohlenhydrate, Proteine) besitzen, was unserer Erwartung vollständig entspricht.
|
|
|
Abb. 6: Verbrennungskalorimetrische Messung des Energiegehaltes verschiedener Proben. Dargestellt sind die Mittelwerte der Doppelbestimmung mit Standardab-weichung. Für Butter wurde nur ein Wert gemessen. (Datentabelle 5) |
Der Unterschied zwischen den Schokoladen ist weniger groß. Die Diätschokolade enthält mit 20 J/mg nur 25% weniger Energie als die normale Schokolade mit 25 J/mg. Bei den Brotaufstrichen fällt der Unterschied um einiges größer aus. Die Halbfettmargarine Lätta enthält mit 10 J/mg im Vergleich zu Butter mit 30 J/mg 67% weniger Energie.
Ergebnisse der Atom-Absorptions-Spektrometrie
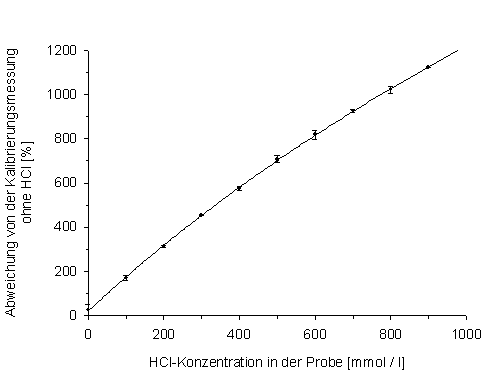
Die Auswirkung verschiedener HCl-Konzentrationen auf die Atom-Absorptions-spektrometrische Bestimmung von Calcium sind in der folgenden Grafik dargestellt: Die Calciumkonzentration, mit der dieser Test gemacht wurde war 2,0 µg/ml.
|
|
|
Abb. 7: Beeinflussung der Calciummessung durch verschiedene HCl-Konzentrationen |
Durch die verschiedenen zusätzlichen HCl- Mengen, die dieser Calciumkonzentration zugesetzt wurden, hat sich die Absorption und somit die aus der Kalibrierungsgerade ermittelte Calciumkonzentration um ein vielfaches nach oben verändert, ohne, dass sich die Calciumkonzentration in Wirklichkeit verändert hat. Den prozentualen Unterschied, der durch die verschiedenen HCl-Mengen entstand, ist in der Abb. X zu sehen. Hier sieht man, dass zum Beispiel eine HCl-Konzentration von 600 mmol/l in der zu messenden Probe eine um ca. 800% gesteigerte Calciumionenkonzentration als Messergebnis ergibt. Der Zusammenhang zwischen Höhe der HCl-Konzentration und prozentualer Veränderung des ursprünglichen Messwertes ist nahezu linear (y = 1,25x+40).
Mit dieser Gleichung sollten also Ergebnisse der Calciummessung von Proben, die mit HCl von bspw. der Präparationen versetzt sind, verrechnet werden, nachdem die HCl-Konzentration zuvor bestimmt worden ist. Mit diesem Ergebnis wird unsere Erwartung nicht bestätigt, wonach eine steigende Menge HCl zu einer Abnahme der messbaren Calciumionen führt, indem diese durch die Chloridionen komplexiert werden. Diese Komplexierung kann durchaus stattfinden, führt jedoch zu einer extrem erhöhten Absorption und somit gemessener Calciumionenkonzentration. Ein Grund dafür könnte sein, dass die Komplexe auch Licht der Wellenlänge von Calcium absorbieren können, da in ihnen ja Calcium enthalten ist, und zwar sogar in einem sehr viel höheren Maße.
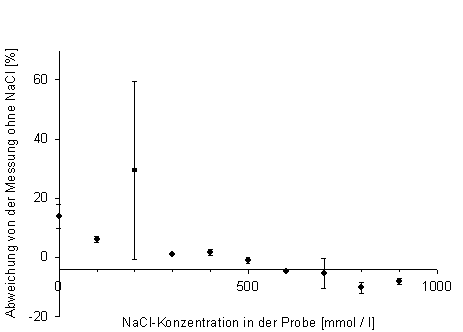
Bei NaCl fällt die Stärke der Beeinflussung wesentlich geringer aus als im Vergleich zu HCl.
|
|
|
Abb. 8: Beeinflussung der Calciummessung durch verschiedene NaCl-Konzentrationen |
Die Abweichungen gehen hier nicht über 20% hinaus und gehen auch ohne erkennbaren Zusammenhang teilweise ins negative, was darauf hindeutet, dass es sich hier um messungsbedingte Schwankungen handelt, die nicht durch die zusätzlichen Mengen NaCl hervorgerufen werden. Es ist wenn überhaupt eine abnehmende Tendenz der Abweichung vom Ursprungswert mit steigender NaCl-Konzentration, die zugegeben wurde, zu erkennen.
Anscheinend kommt es nicht zu der bei HCl erwähnten Koplexierung unter Anwesenheit von NaCl. Eine Erklärung haben wir dafür jedoch nicht
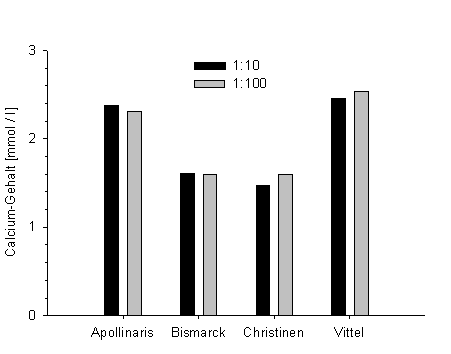
Bei der anschließenden Bestimmung des Calciumgehaltes von verschiedenen Mineralwassern zeigte sich, dass unterschiedliche Probenverdünnungen zu – im Rahmen der Messgenauigkeit – gleichen Werten führen.
|
|
|
Abb. 9: Bestimmung der Calciumkonzentration in Mineralwassern bei verschiedenen Probenverdünnungen. |
|
|
Mittelwert der |
Herstellerangaben |
|
Apollinaris |
2,40 |
2,49 |
|
Bismarck |
1,60 |
1,55 |
|
Christinen |
1,55 |
1,37 |
|
Vittel |
2,60 |
2,27 |
Im Vergleich zu den Messungen, die mit der Kapillarelektrophorese durchgeführt wurden, gibt es nur bei den Wassern Bismarck mit 1,76 mmol/l und Vittel mit 2,87 mmol/l annähernd die gleichen Ergebnisse.